Thu hồi 11 loại thuốc có chứa tạp chất nguy cơ gây ung thư
Cục Quản lý Dược (Bộ Y tế) cho biết, căn cứ vào các quy chế dược hiện hành của Việt Nam; căn cứ thông báo của Cơ quan Khoa học y tế Singapore (HSA), Cơ quan quản lý dược phẩm Thụy Sĩ (Swissmedic) về việc thu hồi các thuốc chứa Ranitidine do phát hiện chứa tạp chất N-nitrosodimethylamine (NDMA) có nguy cơ gây ung thư ở hàm lượng vượt quá ngưỡng cho phép của quốc tế.
Để đảm bảo an toàn cho người sử dụng, Cục Quản lý Dược yêu cầu thu hồi tất cả các thuốc thành phẩm có tên sau đây:
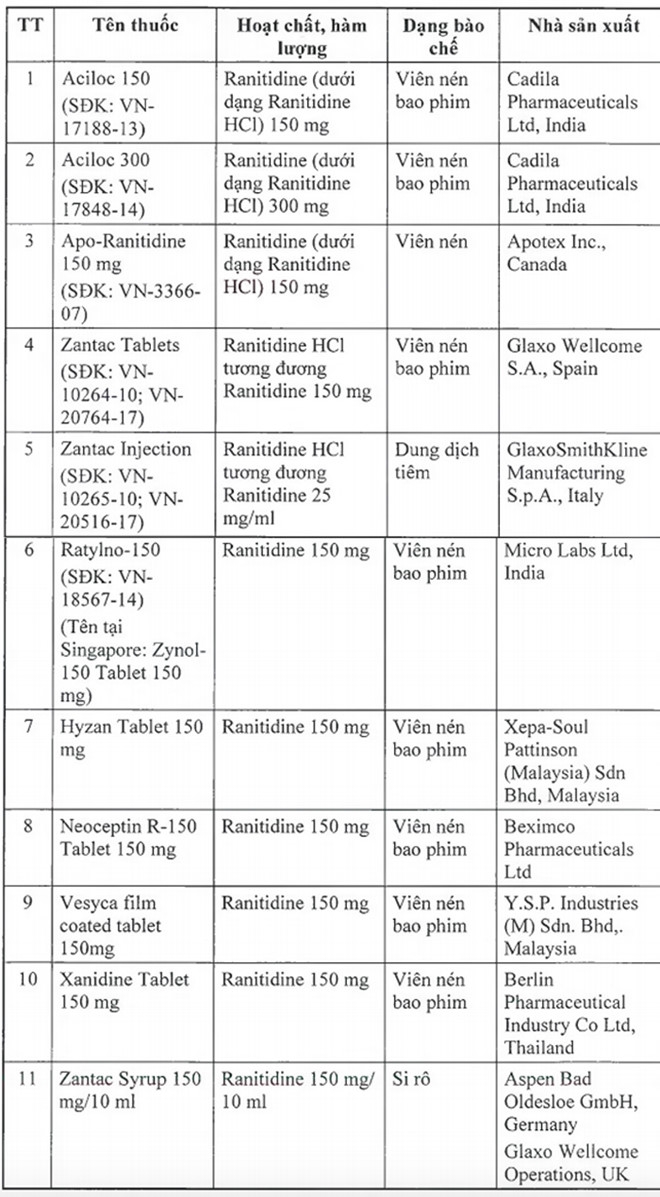 |
| Bộ Y tế thu hồi 11 loại thuốc có chứa tạp chất nguy cơ gây ung thư |
Theo ông Đỗ Văn Đông – Phó Cục trưởng, Cục Quản lý Dược (Bộ Y tế), trong lần thu hồi này, Cục yêu cầu tất cả các công ty nhập khẩu thuốc phải có trách nhiệm phối hợp với nhà phân phối để thông báo và thu hồi tất cả lô thuốc thành phẩm tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc.
Thời hạn thực hiện là trong vòng một tháng, các công ty phải gửi báo cáo về cục, bao gồm số lượng nhập khẩu, số lượng thu hồi, các bằng chứng về việc thực hiện thu hồi tại các cơ sở bán buôn, bán lẻ, sử dụng đã mua thuốc.
Sở Y tế các tỉnh, thành phố phải thông báo việc thu hồi tới các cơ sở kinh doanh, sử dụng thuốc trên địa bàn. Kiểm tra và giám sát các Công ty nhập khẩu thuốc trên địa bàn thục hiện việc thu hồi các thuốc nêu trên.
Cục Quản lý Dược yêu cầu các cơ sở nhập khẩu thuốc, nguyên liệu dược chất Ranitidine thực hiện nghiêm túc việc đánh giá cơ sở cung cấp, cơ sở sản xuất nguyên liệu, cơ sở sản xuất thuốc thành phẩm.
Cơ sở nhập khẩu nguyên liệu chỉ nhập khẩu các lô nguyên liệu Ranitidine đạt tiêu chuẩn chất lượng theo tiêu chuẩn đã được chấp nhận, đồng thời không có hoặc không vượt quá giới hạn cho phép các tạp chất NDMA. Cơ sở nhập khẩu chịu trách nhiệm lưu trữ các bằng chứng chứng minh lô nguyên liệu nhập khấu đáp ứng yêu cầu trên.
Cơ sở nhập khẩu thuốc phải phối hợp với cơ sở sản xuất thuốc nuớc ngoài đảm bảo thuốc chứa dược chất Ranitidine được sản xuất từ nguồn nguyên liệu không có hoặc không vượt quá giới hạn tạp chất NDMA. Cơ sở nhập khẩu thuốc chịu trách nhiệm về việc lưu trữ các bằng chứng chứng minh từng lô thuốc nhập khẩu đạt tiêu chuẩn chất lượng và được sản xuất từ lô nguyên liệu dược chất Ranitidine đáp ứng yêu cầu nêu trên.